Was ist eigentlich ein Quantensprung?
Den siebzigsten Geburtstag der Fraunhofer-Gesellschaft in diesem Jahr nahm ich zum Anlass, mich etwas näher mit dem Quantensprung zu beschäftigen. Schließlich sind die berühmten Fraunhofer-Linien direkte Folgen von Quantensprüngen. Unser Namenspatron Joseph von Fraunhofer entdeckte um 1814 etwa 570 zu dieser Zeit geheimnisvolle schwarze Linien (einige sind in der Tabelle zusammengestellt) im Emissionsspektrum der Sonne, die er akribisch katalogisierte, deren Zustandekommen er allerdings nicht erklären konnte, was ohne die moderne Physik des 20. Jahrhunderts auch nicht möglich war. Zerlegt man das Sonnenlicht beispielsweise durch ein hochauflösendes optisches Gitter in seine Spektralfarben, so »fehlen an den Positionen der Fraunhofer-Linien die entsprechenden Farben«.
Der Quantensprung und die fehlenden Farben des Sonnenlichts
Das Strahlungsspektrum der Sonne überspannt einen Wellenlängenbereich von etwa 300 nm (Ultraviolett) bis 3000 nm (Infrarot). Der sichtbare Teil (Licht) liegt zwischen 400 nm und 750 nm, er entsteht in einer der äußeren »Schalen«, der Photosphäre. Werden bestimmte einzelne Wellenlängen aus dem genannten Bereich von in der Photosphäre vorhandenen Atomen absorbiert, entstehen an diesen Positionen im Spektrum schwarze Linien, die praktisch Aufschluss über den »Fingerabdruck« oder die »DNA« dieser Atome geben. Hierin liegt die Bedeutung von Fraunhofers Arbeiten, und daher trug sein ursprünglicher, im zweiten Weltkrieg zerstörter Grabstein die Inschrift
»Approximavit Sidera« – Er brachte uns die Gestirne näher
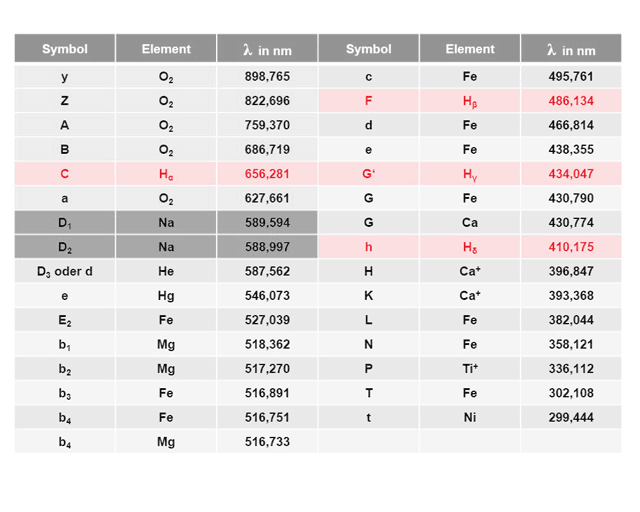
Zu den prominenten Fraunhofer-Linien gehören die in der nebenstehenden Tabelle rot unterlegten und von Fraunhofer unter C, F, G‘ und h katalogisierten Übergänge aus der Balmer-Serie des Wasserstoffatoms. Wir wollen uns daher mit den möglichen Energiestufen (Termen) des Wasserstoffatoms etwas näher beschäftigen. In 1885 stellte Johann Balmer für die Übergänge zwischen diskreten Energiezuständen die Beziehung
λ = A (n²/(n²-4)) (1)
auf. Mit der empirischen Konstanten A = 364,57 nm und n = 3, 4, 5, 6 erhält man die Wellenlängen der oben genannten vier Fraunhofer-Linien bzw. der nach Balmer genannten Linien Hα, Hβ, Hγ, Hδ (siehe Abbildung links unten).
Johannes Rydberg verallgemeinerte die Balmer-Formel zu
1/ λ = RH (1/m2 – 1/n2) (2)
mit: RH = 1,097 x 107 m-1 (Rydbergkonstante für Wasserstoff)
m = 1, 2, 3, ….
n = 2, 3, 4, …
Für den Spezialfall m = 2 und n = 3, 4, 5, 6, … ergibt sich daraus die Balmer-Serie.
Etwa 100 Jahre nach Fraunhofers Entdeckung erklärte Niels Bohr in 1913 mit seinen Postulaten die Spektren des H-Atoms, er schuf damit das Fundament zum Verständnis des Aufbaus der Atome und damit auch die umfassende Erklärung für das Zustandekommen der Fraunhofer-Linien.
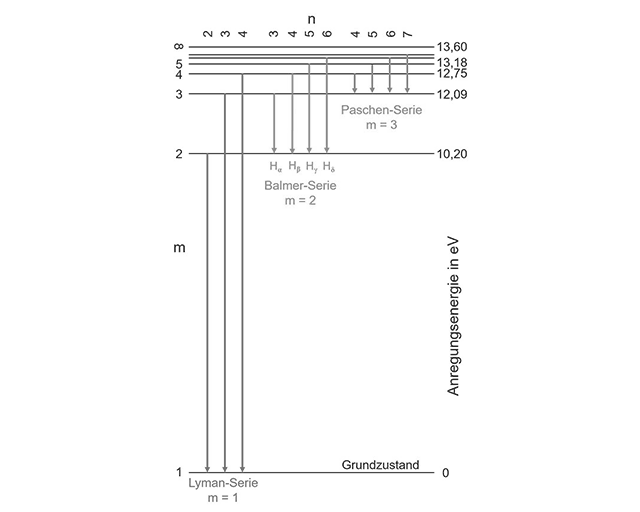
Nach Bohr kann das Elektron im Wasserstoffatom neben dem Grundzustand verschiedene angeregte Zustände annehmen, d. h. durch Einstrahlung äußerer Energie in Form eines Lichtquants auf eine energetisch höhere Bahn gehoben werden. Beim »Rücksturz« in den Grundzustand wird die entsprechende Energiemenge wieder abgestrahlt, je nach Wellenlänge entsteht Licht einer bestimmten Farbe. Dabei sind die aufgenommenen bzw. abgegebenen Energiemengen nicht beliebig, sondern entsprechend Gleichung (2) »gequantelt«.
Die nebenstehende Abbildung zeigt das Termschema des Wasserstoffatoms. Die Grenzenergie für die Ionisierung, d. h. die völlige Ablösung des Elektrons vom Atomrumpf, beträgt 13,60 eV. Alle möglichen Quantensprünge für den Wasserstoff müssen also unterhalb dieser Grenzenergie liegen. Im Periodensystem der Elemente besitzt Helium mit 24,60 eV die höchste Ionisierungsenergie.
Als Grundlage für unsere Rechenbeispiele wählen wir die energiereichste der in der Abbildung eingezeichneten Linien, den Übergang 4 → 1 der Lyman-Serie. Mit einer Energiedifferenz von 12,75 eV ist dies aus atomarer Sicht schon ein riesiger Quantensprung.
Liebe Leserin, lieber Leser,
wer von uns würde in Verbindung mit der Fortbewegung einer Schnecke von Quantensprüngen sprechen? Der Begriff »Schneckentempo« bedarf keiner weiteren Erläuterung. Die Schnecke, die sich mit einer typischen Geschwindigkeit von 3,6 m/h fortbewegt, gilt als eines der langsamsten Lebewesen der Erde. Und dennoch: Ihre Bewegungsenergie ist äquivalent zu 7 Milliarden Quantensprüngen.
Geben wir umgekehrt der Schnecke die Energie unseres ausgewählten Quantensprungs, so bremsen wir sie auf 10-8 m/s ab. In 24 Stunden schafft sie dann etwa einen Millimeter, das ist nur noch doppelt so schnell wie das Wachstum des menschlichen Haares.
Auch ein Fraunhofer-Mitarbeiter, der in seinem PKW in freudiger Erwartung eines Kundenauftrags mit 150 km/h auf der Autobahn unterwegs ist (und damit die von seinem Arbeitgeber vorgegebenen Richtlinien missachtet), ist in unserer Alltagswelt nichts Ungewöhnliches. Er kann über den Quantensprung nur den Kopf schütteln, fährt er doch mit einem Energieinhalt von 4 x 1023 Quantensprüngen!
Zum Abschluss ein Vergleich aus der Hochenergiephysik: Bei einer einzigen Kernfusionsreaktion, bei der zwei Wasserstoff-Isotope zu einem Heliumatom verschmelzen, wird aufgrund des Massendefekts nach Einsteins Gleichung E = mc² eine Energie von 17,6 MeV frei, sie entspricht mehr als einer Million Quantensprüngen der Energiedifferenz von 12,75 eV im Wasserstoffatom.
Also: Seien Sie, liebe Leserinnen und liebe Leser, in Zukunft etwas vorsichtig, wenn Sie den Quantensprung als Synonym für eine besonders aufregende Entwicklung in den Mund nehmen wollen. Er ist nur ein winziger Hauch eines Energiepakets, die sanfte Luftbewegung beim Flügelschlag eines Schmetterlings im Vergleich zu einem Orkan. Der Begriff »disruptiv« ist doch gerade auch sehr schick, oder?
Letzte Änderung: